ЙодМатериалы по медицине / Йод
Йод знают все. Порезав палец, мы тянемся к склянке с Йодом, точнее с его спиртовым раствором. Но не все знают насколько важно содержание Йода в нашем организме. Йод является очень сильным антисептическим препаратом. Однако Йод служит не только для смазывания ссадин и царапин. Хотя Йода в человеческом организме всего 25 мг, он играет важную роль. Большая часть «человеческого Йода» находится в щитовидной железе: он входит в состав вещества, которое регулирует обмен веществ в организме. При недостатке Йода задерживается физическое и умственное развитие и возникает болезнь, называющаяся эндемический зоб. Это случается в высокогорных районах, где естественное содержание Йода в воздухе, воде и пище очень низкое.
Немного истории
Описание элемента

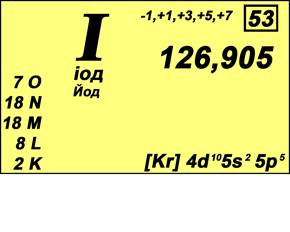 Йод – химический элемент VII группы
периодической системы Менделеева. Атомный номер - 53. Относительная атомная
масса 126,9045 (рис. 1). Галоген. Из имеющихся в природе галогенов – самый
тяжёлый, если, конечно, не считать радиоактивный короткоживущий астат.
Практически весь природный Йод состоит из атомов одного – единственного изотопа
с массовым числом I
Йод – химический элемент VII группы
периодической системы Менделеева. Атомный номер - 53. Относительная атомная
масса 126,9045 (рис. 1). Галоген. Из имеющихся в природе галогенов – самый
тяжёлый, если, конечно, не считать радиоактивный короткоживущий астат.
Практически весь природный Йод состоит из атомов одного – единственного изотопа
с массовым числом I
127
, его содержание в земной коре 4 * 10-5 % по массе. Радиоактивный Йод I
125
образуется в ходе естественных радиоактивных превращений. Из искусственных изотопов Йода важнейшие – Йод I
131
и Йод I
133
. их в основном используют в медицине.

 I2
I2
– галоген. Темно-серые кристаллы с металлическим блеском. Летуч. Плохо растворяется в воде, хорошо – в органических растворителях (с фиолетовым или коричневым окрашиванием раствора) или в воде с добавкой солей – Йодидов. Слабый окислитель и восстановитель. Реагирует с концентрированными серной и азотной кислотами, металлами, неметаллами, щелочами, сероводородом. Образует соединения с другими галогенами.
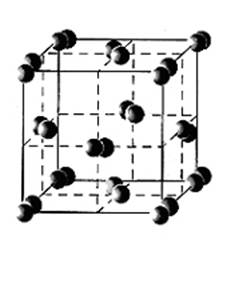
Молекула элементного Йода, как и прочих галогенов, состоит из двух атомов. Йод – единственный из галогенов – находится в твёрдом состоянии при нормальных условиях. Красивые тёмно – синие кристаллы Йода больше всего похожи на графит. Отчётливо выраженное кристаллическое строение (рис. 2), способность проводить электрический ток – все эти «металлические» свойства характерны для чистого Йода.
Открытие Йода
Конец XVII и начало XVIII века были отмечены в Европе непрекращающимися войнами. Требовалось много пороха и, следовательно, много селитры. Производство селитры приняло невиданные масштабы, наряду с обыкновенным растительным сырьём в дело шли и морские водоросли. В них и обнаружили новый химический элемент.
Одним из французских селитроваров был химик и промышленник Бернар Куртуа (1777–1838), он был весьма наблюдательным человеком. Считается, что именно это помогло ему в 1811 г. стать первооткрывателем нового химического элемента Йода. Однажды он заметил, что медный котёл, в котором выпаривался щелок, полученный из фукуса, ламинарий и других бурых водорослей, быстро разрушается, как будто его разъедает какая – то кислота. Куртуа решил выяснить, в чём тут дело. Осадив и удалив из раствора соли натрия, он выпарил раствор, обнаружил в котле сульфид калия и чтобы разложить его, прилил к осадку концентрированной серной кислоты – и тут появился фиолетовый дым. Куртуа повторил опыт, на этот раз в реторте, и в приёмнике реторты осели блестящие чёрные пластинчатые кристаллы.
Йодид натрия из водорослей, взаимодействуя с серной кислотой, выделяет Йод I2
; одновременно образуется сернистый газ – диоксид серы SO2
и воду:
2NaI + 2H2SO4 = I2 + SO2 + Na2SO4 + 2H2O
При охлаждении пары Йода превращались в темно-серые кристаллы с ярким блеском. Куртуа писал: «В маточном растворе щелока, полученного из водорослей, содержится довольно большое количество необычного вещества. Его легко выделить: для этого достаточно прилить серную кислоту к данному раствору и нагреть смесь в реторте... Новое вещество осаждается в приемнике в виде черного порошка, который при нагревании превращается в пары великолепного фиолетового цвета».
Название новому элементу присвоил в 1813 году французский химик Жозеф-Луи Гей-Люссак (1778–1850) за фиолетовый цвет его паров («Йодос» по-гречески значит «фиолетовый»). Он же получил многие производные нового элемента – Йодоводород HI
, Йодноватую кислоту HIO3
, оксид Йода(V) I2O5
, хлорид Йода ICl
и другие. Практически одновременно элементарную природу Йода доказал и английский химик Гэмфри Дэви (1778–1829).
Интересные факты
1. содержание Йода в крови человека зависит от времени года: с сентября по январь концентрация Йода в крови снижается, с февраля начинается новый подъём, а в мае–июне Йодное зеркало достигает наивысшего уровня. Эти колебания имеют небольшую амплитуду, и их до сих пор остаются загадкой;
2. из пищевых продуктов много Йода содержат яйца, молоко, рыба; очень много Йода в морской капусте, которая поступает в продаже в виде консервов, драже и других продуктов;
3. первый в России Йодный завод был построен в 1915 г. В Екатеринославле (ныне Днепропетровск); получали Йод из золы черноморской водоросли филлофоры; за годы первой мировой войны на этом заводе было добыто 200 кг Йода;
4. если грозовое облако «засеять» Йодистым серебром или Йодистым свинцом, то вместо града в облаке образуется снежная крупа: засеянное такими солями облако проливает дождём и не вредит полям.
Смотрите также
Контроль за уровнем системного артериального давления и его коррекция
В ряде случаев выгодно создать после перенесенного
терминального состояния гиперперфузию головного мозга на 5—7 минут путем
искусственного моделирования системной гиперперфузии (для борьбы с феномен ...
Элементы цигун-тренировки
В практике цигун чрезвычайно важно понимать принцип любого действия. Принцип
--это корень вашей практики, основа для достижения желаемого результата. Именно
корень является источником жизни, тогда к ...
Электрохирургия. Дарсонвализация и терапия током надтональной частоты
...





 В 19 веке выяснели, что пищевая ценность продуктов определяется содержанием в основном следующих веществ: белков, жиров, углеводов, минеральных солей ...
В 19 веке выяснели, что пищевая ценность продуктов определяется содержанием в основном следующих веществ: белков, жиров, углеводов, минеральных солей ... Иммунология - молодой раздел науки, но уже первые результаты ее применения в профилактике и лечении открывают широкие перспективы ...
Иммунология - молодой раздел науки, но уже первые результаты ее применения в профилактике и лечении открывают широкие перспективы ... Большое значение для внешнего облика человека имеет чистая, гладкая, приятного оттенка кожа лица. К сожалению, не всегда за ней обеспечен правильный уход ...
Большое значение для внешнего облика человека имеет чистая, гладкая, приятного оттенка кожа лица. К сожалению, не всегда за ней обеспечен правильный уход ...

